Optogénétique:Comment on étudie l’âme aujourd’hui en neurosciences

CLAUDE BRAUN
Administrateur et éditeur en chef du "Québec humaniste"
Claude Braun a été professeur de neurosciences cognitives à l'UQAM de nombreuses années. Retraité depuis peu, Il a publié nombres de documents de recherches sur le sujet. Il a été également éditeur du "Québec laïque" et est depuis quelques années l'éditeur en chef de notre revue "Québec humaniste" Il a également publié "Québec Athée" en 2010. Téléchargeable gratuitement en utilisant ce lien avec les compliments de l'auteur.
Lorsque fut mise au point la technique électroencéphalographique ou ÉEG au tournant du siècle jusqu’aux années 1950, Caton et Berger reprirent les paramètres classiques de la vie mentale, sommeil, éveil, attention, mémoire, perception, action, en en déterminant le contour électrique au scalpe. Lorsqu’on apprit à enregistrer l’activité ionique de neurones individuels dans les décennies qui suivirent tous les mêmes éléments de la vie mentale ont été à nouveau caractérisés par Adrian, Eccles et successeurs chez l’animal et chez les patients épileptiques dans leur rapport à l’activité de neurones catégorisés selon leurs spécialités psychologiques.
Au courant des années 70 une technique nucléaire, la tomographie par émission de positons (TEP) permit de faire de façon minimalement invasive des déterminations métaboliques dans le sang cérébral de personnes neurotypiques en termes de calculs de concentrations de positons. Une autre technique exploita notre capacité de cartographier l’émission de photons (SPECT). Par la suite, la cartographie spatiotemporelle du cerveau pendant les activités mentales bénéficia de nouvelles techniques de plus en plus performantes, soit avec une meilleure résolution spatiale, comme l’imagerie par résonance magnétique (IRMf) ou une meilleure résolution temporelle comme l’imagerie optique (IOf).
La mise au point de stimulation magnétique transcrânienne pour la psychophysiologie dans les années 80 ou de stimulation à courant électrique direct a lancé une nouvelle entreprise de caractérisation de la vie mentale. Dorénavant, on pouvait légèrement inhiber ou exciter une région spécifique du cerveau, même d’humains neurotypiques, et noter les variations du comportement. Avec ces outils, les variations que l’on observe dans le comportement ne sont pas très spécifiques ou saillantes toutefois. Et les modifications subjectivement vécues non plus, hélas.
Chacune de ces techniques a apporté un approfondissement important de nos connaissances scientifiques sur la vie mentale, mais aucune technique n’est dépourvue de contraintes dérangeantes et limitantes et aucune ne présente une résolution spatiotemporelle parfaite. Par exemple, l’IRMf, dont les usagers sont si fiers et qui donne de si belles images en couleur dans nos périodiques scientifiques, ne peut mesurer en réalité que des changements métaboliques incompris au plan cellulaire, globalement causés principalement par les glies, dans des populations de millions de cellules non caractérisées chimiquement. En plus, la technique est extraordinairement dispendieuse et elle est extrêmement peu écologique, le participant devant rester immobile dans un tube très bruyant. Ce tube est toujours situé dans un hôpital.
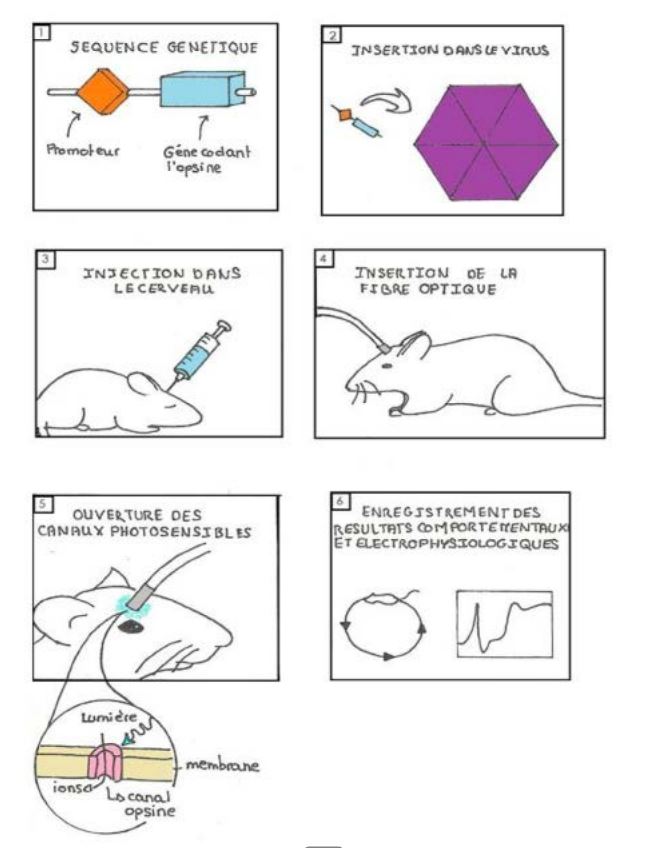
Ces limitations de la technique IRMF sont présentement en voie d’être résolues grâce à une nouvelle méthode. Cette méthode, nommée technique de l’année par Nature Methods en 2010 [1], est l’optogénétique. En injectant à un endroit spécifique du cerveau des virus porteurs de gènes codant pour certaines molécules photosensibles (opsines), les chercheurs peuvent ensuite activer ou inactiver, avec une lumière très spécifique, les neurones s’étant auto-équipés de ces dits récepteurs de lumière. Le virus installe le gène dans le génome du neurone et ce génome produit ensuite lui-même la molécule photoréceptrice qui s’installe comme récepteur extra synaptique le long de l’axone.
Selon l’opsine choisie, on peut inhiber ou exciter le neurone. Par exemple, la channelrhodopsine 2 (ChR2), dont le gène est tiré d’algues unicellulaires, s’ouvre à la lumière bleue, laissant entrer les ions Na+ dans les neurones, ce qui les dépolarise, et les rend excitables. L’halorhodopsine (NpHR), dont le gène est tiré d’archéobactéries, s’ouvre à la lumière jaune, laissant entrer les ions Cl- dans les neurones, ce qui les hyperpolarise, et les rend, à l’inverse, inexcitables.
Une fois l’auto-production de la nouvelle protéine établie, l’animal est transgénique, mutant. L’exploitation des virus en optogénétique va bien plus loin. On peut triturer le virus pour transporter non seulement le gène de l’opsine cible mais aussi pour n’avoir une affinité que pour un neurone d’un type extrêmement précis [2[. Toutefois, l’ingéniosité des spécialistes de la biologie moléculaire ne s’arrête pas là non plus. On a créé des virus porteurs de gènes « chimère » fusionnant une opsine à un peptide, une autre sorte de récepteur pouvant avoir un rôle spécifique dans tel ou tel vécu mental ou comportement géré dans tel ou tel groupe de circuits neuronaux [3].
La procédure dans sa phase virale est entièrement bénigne. Les virus utilisés en optogénétique sont désarmés, bénins : ils ne rendent pas l’animal malade. Le plus souvent le neurone est ensuite manipulé in vitro ou in vivo avec fibre optique implantée au cerveau. Mais on peut même dans certaines situations étudier et manipuler les neurones cibles de l’animal alors qu’il est libre de tous ses mouvements dans n’importe quel environnement. Pour cela on remplace une partie du crâne par une version transparente faite d’une sorte de silice comme le zircon par exemple.
Bref, avec une simple lumière pulsée, les chercheurs peuvent aujourd’hui faire manifester des comportements très spécifiques chez des mammifères en activant des groupes de neurones de réseaux extrêmement bien caractérisés chimiquement. De plus, les résolutions spatiale et temporelle des manipulations expérimentales représentent une immense avancée par rapport aux techniques précédentes. Les récepteurs photiques, comme tout récepteur, sont des molécules qui peuvent se conformer/reconformer en quelques dizaines de microsecondes, sans s’épuiser, des heures durant. Ainsi, on peut facilement pulser de l’énergie photique à de très hauts rythmes ou pour des périodes très brèves afin de caractériser des modifications beaucoup plus lentes observées au potentiel d’action loin en aval, qui lui ne se manifeste qu’au rythme d’environ un potentiel par milliseconde par neurone. Il reste que le principal porteur d’information à valeur psychique dans le cerveau reste ce potentiel d’action. Chaque neurone et chaque microcircuit a son rythme précis de sensibilité à la lumière et de production de potentiels d’action aptes à engendrer un comportement ou un vécu mental particulier.
L’importance de cette nouvelle méthodologie ne peut être sous-estimée : elle représente le pont tant attendu entre micro et macro biologie. Elle comporte une résolution temporelle et spatiale bien meilleure que son plus performant prédécesseur. On peut manipuler des populations aussi limitées que quelques centaines de neurones jusqu’au cerveau au complet. La résolution temporelle de la manipulation est de l’ordre de la milliseconde et on peut ainsi isoler, sans distorsion, la fonction de petits réseaux neuronaux interconnectés à de nombreux autres microcircuits dans les aires cérébrales.
Pour rendre compte de ce qu’accomplit cette méthode imaginons un jouet comme un petit camion téléguidé par une console-antenne radio à manettes. Seulement, remplacez le récepteur radio du camion par un ou plusieurs neurones du type exact qui vous intéressent, l’émetteur radio par une lampe et le camion par le corps complet Nous pouvons activer ou désactiver les neurones de notre choix, à distance, de façon immédiate, précise et bénigne. Et nous pouvons faire faire au camion ce que nous voulons.
L’optogénétique entrouvre la possibilité maintenant de caractériser la contribution de neurones au comportement et à la vie mentale selon leur spécificité chimique (par exemple selon le neurotransmetteur qu’ils utilisent, ou selon toute autre particularité telle le type anatomique de neurone, la combinaison de récepteurs extra-synaptiques du neurone, la connectivité microcircuitaire du neurone, etc.) [2]. De plus, lorsque l’animal est prêt à être stimulé, il peut être parfaitement intact et il est possible de le stimuler et d’observer l’effet de cette stimulation de façon complètement non-invasive, noncontraignante, en situation parfaitement écologique pour l’espèce. On peut observer les comportements de l’animal mais on peut aussi mesurer l’activité électrique de certains neurones individuels ou de collectivités de neurones. On peut combiner l’optogénétique avec n’importe quelle autre technique d’imagerie cérébrale ou de neurophysiologie.
Une communauté avant-gardiste de chercheurs s’affaire présentement à redéfinir le monde intérieur du comportement et de la vie mentale, molécule par molécule, neurone par neurone et circuit par circuit. La complexité et la finesse des résultats attendus sont phénoménales. L’aventure ne fut concluante chez la mouche qu’en 2005, et le terme d’optogénétique ne fut inauguré qu’en 2006 par Nathalie Janel et et Mark J. Schnitzer. Mais aujourd’hui, on peut déjà, avec une simple illumination pulsée, produire des comportements très saillants et très spécifiques (comportement de peur par exemple) chez la souris transgénétique. L’optogénétique n’a pas tardé à livrer de nombreuses percées dans notre compréhension des maladies neurologiques [4] et psychiatriques [5] telles parkinsonisme, autisme, schizophrénie, dépression, toxicomanie, etc.
- Primer on Optogenetics: Pastrana, Erika (2010). «Optogenetics: Controlling cell function with light». Nature Methods 8 (1): 24–25. Editorial: «Method of the Year 2010». Nature Methods 8 (1): 1. 2010. Commentary: Deisseroth, Karl (2010). «Optogenetics». Nature Methods 8 (1): 26–9.
- Tsien JZ, et al (1996). Subregion- and cell type-restricted gene knockout in mouse brain. Cell. 1996 Dec 27;87(7):1317-26.
- Kim, J. M.; Hwa, J.; Garriga, P.; Reeves, P. J.; RajBhandary, U. L.; Khorana, H. G. (2005). «Light-driven activation of beta 2-adrenergic receptor signaling by a chimeric rhodopsin containing the beta 2-adrenergic receptor cytoplasmic loops». Biochemistry 44 (7): 2284–92.
- Tønnesen, J. (2013). Optogenetic cell control in experimental models of neurological disorders. Behavioural Brain Research, 255, 35-43.
- Deisseroth, K. (2012). Optogenetics and psychiatry: applications, challenges, and opportunities. Biological Psychiatry, 71(12), 1030-1032.
“ Puissent tous les hommes se souvenir
qu’ils sont frères.” Voltaire.


0 commentaires